Atom adalah partikel terkecil di suatu unsur.
Perkembangan Teori Atom
- Teori atom klasik
Menurut Democritus bahwa materi bersifat diskontiniu yaitu tidak dapat terbagi lagi. Sedangkan menurut Aristoteles materi bersifat continiu yaitu dapat dibagi terus.
Materi yang tidak dapat dibagi lagi disebut atom yang berasal dari kata :
a " tidak
tomos " terbagi - Teori atom modern
- Model atom John Dalton

Teori atom modern pertama kali dikenalkan oleh John Dalton yaitu :
a. Atom yaitu bagian terkecil penyusun materi yang tidak dapat dibagi lagi
b. Atom suatu unsur mempunyai sifat yang sama dan berbeda dengan atom unsur yang lain
c. Atom-atom dapat bergabung membentuk molekul unsur molekul senyawa
d. Suatu reaksi kimia merupakan reaksi penghubungan atom (reaksi penataan ulang)
- Model atom J.J.Thomson

Teori atom Dalton cukup lama dipakai para ahli sampai ditemukannya elektron oleh J.J.Thomson yang mematahkan teori atom Dalton yang mengatakan bahwa atom adalah materi terkecil elektron yang ditemukan Thomson dalam suatu atom bermuatan negatif sehingga jika unsur netral maka ada muatan positif. Jadi teori atom Thomson adalah :
a. Atom merupakan bola pejal yang bermuatan positif
b. Pada tempat tertentu terdapat elektron yang bermuatan negatif
- Model atom Rutherford

Menurut Rutherford yang melakukan percobaan dengan menembakkan lempengan logam dengan partikel alfa ternyata ada partikel yang diteruskan dan ada yang dipantulkan (dibelokkan). Jadi teori atom Rutherford adalah :
a. Atom terdiri dari inti atom yang bermuatan positif dan netral. Dan elektron yang beredar mengelilingi inti atom yang bermuatan positif
b. Banyaknya elektron di sekitar inti atom sama dengan banyaknya muatan positif pada inti atom (atom bersifat netral)
- Model atom Niels Bohr

Salah satu kelemahan Rutherford mengapa elektron tidak jatuh pada inti. Kelemahan ini disempurnakan oleh Niels Bohr yang mengembagkan teori atom dengan mengambarkan teori tingkat energi di dalam atom. Model atom Niels Bohr menyatakan :
a. Atom terdiri dari inti yang bermuatan positif dan dikelilingi oleh elektron yang bermuatan negatif
b. Elektron dapat berpindah dari satu lintasan ke lintasan yang lain dengan menyerap energi atau memancarkan energi sehingga energi elektron atom itu tidak berkurang. Jika berpindah lintasan ke yang lebih tinggi, akan menyerap energi, dan jika ke lintasan yang lebih rendah akan memancarkan energi
c. Kedudukan elektron "pada tingkat" energi tertentu disebut kulit "elektron"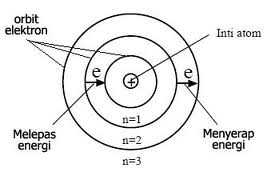
- Model atom mekanika kuantum/modern
Model atom Niels Bohr hanya cocok untuk atom hidrogen yang memiliki elektron, tetapi tidak cocok untuk atom dengan banyak elektron.
Dasar teori mekanika kuantum adalah hipotesis Louis Debroglie dan asas ketidakpastian dari Heisenberg, serta persamaan gelombang Erwin Schrodinger.
Teori atom modern menyatakan bahwa kulit-kulit elektron bukan kedudukan yang pasti dari suatu elektron, tetapi hanyalah suatu keboleh jadian saja, ruang atau tempat itu disebut dengan orbital.

- Model atom John Dalton
Partikel Dasar Penyusun Atom
Partikel-partikel penyusun atom :
 A = nomor massa (Ar)
A = nomor massa (Ar)
Z = nomor atom
X = lambang atom
A = jumlah proton + jumlah neutron = P + N
Z = jumlah proton = jumlah elektron
A-Z = jumlah neutron
dan dapat juga ditulis :

Isotop => atom-atom yang memiliki nomor atom/jumlah proton yang sama, tetapi massa atom berbeda
Isobar => atom-atom yang memiliki massa atom yang sama, tetapi nomor atom berbeda
Isoton => atom-atom yang mempunyai jumlah netron yang sama.
Sumber :
diambil dari materi Kimia SMA/MA
- Elektron (e =
e- )
Elektron ditemukan oleh J.J.Thomson (1897) dengan melakukan percobaan tabung sinar katoda. Sinar yang keluar dari tabung tersebut disebut sinar katoda yang mempunyai sifat sebagai berikut :
a. Merambat dari garis lurus dari katoda
b. Bermuatan negatif karena dapat ditarik lempeng bermuatan positif
c. Sinar katoda terdiri atas partikel bermuatan listrik negatif yang disebut elektron
d. Sinar katoda tidak tergantung dari bahan katoda yang membuktikan bahwa elektron merupakan partikel dasar dari semua zat. - Proton (P)
Proton ditemukan oleh Eugene Goldstein (1932) yang melakukan percobaan. Pada tabung sinar katoda yang telah dimodifikasi yang dihubungkan dengan sumber listrik tergantung tinggi dan menghasilkan sinar yang keluar dari saluran katoda. Sinar ini disebut sinar positif. - Neutron/Netron (N)
Netron ditemukan oleh James Chadwick (1932) yang melakukan percobaan terhadap logam yang ditembak dengan sinar X yang menghasilkan sinar dengan daya tembus yang sangat kuat. Sinar ini terdiri atas partikel tidak bermuatan listrik yang disebut neutron/netron.
Lambang Massa dan Muatan Inti Atom
Inti atom terdiri atas proton dan netron yang disebut dengan NUKLEON.
Secara umum lambang atom dirumuskan sebagai berikut :
Secara umum lambang atom dirumuskan sebagai berikut :
 A = nomor massa (Ar)
A = nomor massa (Ar)Z = nomor atom
X = lambang atom
A = jumlah proton + jumlah neutron = P + N
Z = jumlah proton = jumlah elektron
A-Z = jumlah neutron
dan dapat juga ditulis :

Isotop => atom-atom yang memiliki nomor atom/jumlah proton yang sama, tetapi massa atom berbeda
Isobar => atom-atom yang memiliki massa atom yang sama, tetapi nomor atom berbeda
Isoton => atom-atom yang mempunyai jumlah netron yang sama.
Sumber :
diambil dari materi Kimia SMA/MA

Tidak ada komentar:
Posting Komentar